金属イオンの分析に必須の性質をまとめます。正確に暗記できれば難関大で出題される金属の系統分離の問題はほとんど解けます。
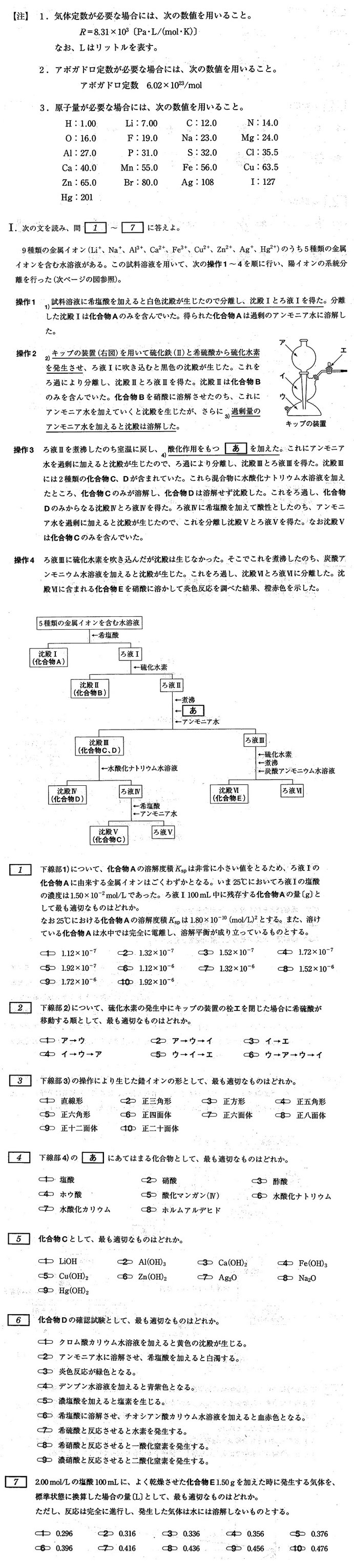
難関中学に進学した生徒たちは小学生のとき、既にこれらの反応の半分ほどの知識があり、大学受験の負担は少なくて済みます。たとえば、基本的なイオン化傾向や炎色反応をはじめ少し複雑なNH3水溶液やNaOH水溶液と金属イオン(Cu2+,Al3+,Zn2+など)との反応なども完璧に覚えています。しかし、公立中の学生たちは、高校で必修の次の反応のほとんどが高校入試には出題されないため学習しておらず高校に入ってはじめて学習するので、その負担は大きくなります。難関大を目指す公立の高校生たちは、化学の本格的学習の開始時期が遅すぎることを自覚して、学業に励むことが肝要です。
イオン化傾向(溶液中(主に水溶液中)における元素(主に金属)のイオンへのなりやすさ)
[貸(K)そうか(Ca)な(Na)ま(Mg)あ(Al)当(Zn)て(Fe)に(Ni)すん(Sn)な(Pb)ひ(H)ど(Cu)過(Hg)ぎ(Ag)る借(Pt)金Au)]
(Li >Ba >) K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
両性元素[あ(Al)あ(Zn)すん(Sn)なり(Pb)両性に愛される)]
Al Zn Sn Pb
酸にも塩基にも溶けて水素を発生する。
3Al+6HCl → 2AlCl3+3H2
2Al+2NaOH+6H2O → 2Na[Al(OH)4]+3H2
Zn+2HCl → ZnCl2+H2O
Zn+2NaOH+2H2O → Na2[Zn(OH)4]+H2
不動態[手(Fe)に(Ni)ある(Al)ものは不動態]
Fe Ni Al
濃硝酸には、不動態を作り溶けない。(第4周期の同周期遷移元素 Fe, Co, Ni は不動態)
炎色反応[リアカー(Li赤)無き(Na黄)K村(K紫)動力(Cu緑)借ろうと(Ca橙)するもくれない(Sr紅)馬力(Ba黄緑)]
Li赤 Na黄 K 紫 Cu青緑 Ca橙 Sr紅 Ba黄緑
アルカリ金属(Li+, Na+, K+など)・NH4+,NO3-は、沈殿をつくらないので、炎色反応で検出する。
塩化物イオン(Cl-)と白色沈殿[円(塩化物)はげん(Ag)なま(Pb)]
Ag → AgCl 。Pb → PbCl2 。
硫酸イオン( SO42-)と白色沈殿[馬(Ba)鹿(Ca)な(Pb)硫酸]
Ba → BaSO4 。Ca → CaSO4 。 Pb → PbSO4 。
炭酸イオン(CO32-)と多くのイオンが反応し白色沈殿する。
主な化合物はCaCO3, BaCO3。
反応しない主なイオンは、Na+, K+, NH4+。
過剰のアンモニア(NH3)に溶ける[度(Cu)を過ぎ(Ag)てあえ(Zn)なく溶けるアンモニア]
Cu → Cu(OH)2 → [Cu(NH3)4] 2+ 正方形(実際には、H2O2個が上下に配位結合して正八面体になる)
Ag → Ag2O → [Ag(NH3)4] + 直線形
Zn → Zn(OH)2 → [Zn(NH3)4] 2+ 正四面体
※ NH3 の電離度は小さいので、両性元素のうちのZnのみが溶ける。
過剰の水酸化ナトリウム(NaOH)に溶ける。
Al → Al(OH)3 → [Al(OH)4] +
Zn → Zn(OH)2 → [Zn(OH)4] 2+ 正四面体
Sn → Sn(OH)2 → [Sn(OH)4]
2+ 正四面体
Pb → Pb(OH)2 → [Pb(OH)4] 2+
※ 全ての両性元素は過剰のNaOHaqで錯イオンをつくり溶ける。[あ(Al)あ(Zn)すん(Sn)なり(Pb)両性に愛される]
硫化物(S2-)と沈殿[参(酸)議院(Ag)どう(Cu)か(Cd)な(Pb)、塩基はあえ(Zn)て(Fe)煮(Ni)こ(Co)まん(Mn)]
酸・中・塩基の水溶液中で沈殿 Ag Cu Cd Pb イオン化傾向小
塩基性の水溶液中のみで沈殿 Zn Fe Ni Co Mn。イオン化傾向大 (Mn,Fe,Co,Niは第4周期遷移元素、Znは第4周期典型元素)
多くは黒色沈殿 → FeS, NiS,PbS,CuS,Ag2S。
黒以外の主な物 →
CdS(黄),MnS(淡桃),ZnS(白)
イオン化傾向(大←→少)と反応との関係
|
金属 条件 |
Li |
K |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Ni |
Sn |
Pb |
(H) |
Cu |
Hg |
Ag |
Pt |
Au |
|
乾燥空気 |
常温で酸化 |
加熱 |
強熱 |
無反応 |
|||||||||||||
|
水 |
常温で反応 |
高温水蒸気 |
ほとんど無反応 |
||||||||||||||
|
酸 |
希酸に溶けて水素発生 |
|
酸化力強の酸 |
王水 |
|||||||||||||
|
イオン 反応物 |
Li |
K |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Ni |
Sn |
Pb |
(H) |
Cu |
Hg |
Ag |
Pt |
Au |
|
硫化水素 |
沈澱しない |
中・塩基性で沈殿 |
液性によらず沈殿 |
|
|
||||||||||||
硫化物沈殿は、イオン化傾向が小さいほどできやすい。
硫化水素
H2S 2H+ + S2- の電離平衝は、
酸性水溶液 では(H+多より)左に偏る。→ S2-の濃度小 → 硫化物沈殿ができにくい。
塩基性水溶液では(H+少より)右に偏る。→ S2-の濃度大 → 硫化物沈殿ができやすい。
主な金属イオンの沈殿反応
|
イオン 試薬 |
Ca2+ 無色 |
Al3+ 無色 |
Zn2+ 無色 |
Fe2+ 淡緑色 |
Fe3+ 黄褐色 |
Pb2+ 無色 |
Cu2+ 青色 |
Ag+ 無色 |
|
|
HCl 水溶液 |
|
× |
× |
× |
× |
× |
PbCl2 白 |
× |
AgCl 白 |
|
H2SO4 水溶液 |
|
CaSO4 白 |
× |
× |
× |
× |
PbSO4 白 |
× |
× |
|
H2S ガス |
酸性 |
× |
× |
× |
× |
× |
PbS 黒 |
CuS 黒 |
Ag2S 黒 |
|
塩基性 |
Al(OH)3 白(※1) |
ZnS 白 |
FeS 黒 |
FeS 黒 |
|||||
|
NH3 水溶液 |
少量 |
× |
Al(OH)3 白 |
Zn(OH)2 白 |
Fe(OH)2 緑白 |
Fe(OH)3 赤褐色 |
Pb(OH)2 白 |
Cu(OH)2 青白 |
Ag2O 褐色 |
|
過剰量 |
無色液1 |
深青液2 |
無色液3 |
||||||
|
NaOH 水溶液 |
少量 |
Ca(OH)2 白 |
Al(OH)3 白 |
Zn(OH)2 白 |
Fe(OH)2 緑白 |
Fe(OH)3 赤褐色 |
Pb(OH)2 白 |
Cu(OH)2 青白 |
Ag2O 褐色 |
|
過剰量 |
無色液5 |
無色液4 |
無色液6 |
||||||
※1 Al2S3が生成されるが直ぐに加水分解してAl2(OH)3になる。
無色液1 [Zn(NH3)4] 2+深青液2 [Cu(NH3)4] 2+ 無色液3 [Ag(NH3)2]+
無色液4 [Zn(OH)4] 2+ 無色液5 [Al(OH)4] 2+ 無色液6 [Pb(OH)4] +
Ba2+は、NaOHでは変化しないが、H2SO4では白色沈殿する。
アルカリ金属(Li+, Na+, K+など)は、沈殿をつくらないので炎色反応で検出する。
問題(金属イオンの系統分離) 難易度は標準(計算問題は基本で易)
北里大学(薬学部)
主な金属イオンの沈殿反応について正確な知識を要求され、難度はセンター試験より高くなりますが、一定以上の観察力・分析力・思考力があれば解けます。Hg2+の反応は、(知らなくても)それ以外の反応から正しく推測できます。
< 解法のポイント >
1. 溶解度積の公式[Ag] (mol/L) [Cl] (mol/L) = Ksp (mol/L)2 に数値を代入し、Aの物質量を求め、質量を求める。
2. 逆流が発生する。
3. [Cu(NH3)4] 2+は正四面体。
4. Fe2+→Fe3+と酸化するために、Mn4+→Mn2+と還元する。
5. NH3水溶液でFe(OH)3、Al(OH)3ができ、NaOH水溶液でAl(OH)3が溶ける。
6. Fe(OH)3に対する操作。
7. CaCO3 + 2HCl → CaCl2 + H2O + CO2 より、気体の物質量を求め、体積を求める。
[ろ液Ⅱ]への操作と結果
煮沸(H2Sを除去)→ 希硝酸滴下(Fe2+→Fe3+酸化) → 過剰アンモニア水付加(ここではFe(OH)3,Al(OH)3が沈殿)
[ろ液Ⅲ]への操作と結果
H2Sを通す(H2Sの存在確認) → 煮沸(H2Sを除去)→ 炭酸アンモニウム水溶液付加(炭酸塩の沈殿、CaCO3が沈殿)
答
1. ④ 2. ④ 3. ③ 4. ② 5. ② 6. ⑥ 7. ③

コメントをお書きください