金属イオンの分離の基本問題です。難易度は基本で易。
4問すべて、昭和大学(薬) 制限時間(12分)
理論化学は、解法は全般的に数学や物理よりも易しい一方で計算が面倒な場合がありますから、多くの問題を解いて効率良く解けるよう鍛錬することが大事です。
薬学部の偏差値(駿台,河合)は次の通りです。国公立は駿台のみ。国公立と私立の学力を偏差値に換算すると(国公立)≒(私立+5)
国公立:京都(66)>大阪(63)>九州(62~61)≧千葉(61)≒岐阜薬科(61)>熊本(60)(>慶應(60))
私立大:慶應(60,65)>北里(53,60)≒星薬科(53,60)>東京薬科(51,55)>昭和薬科(50,52.5)≒昭和(50,52.5)>日大(48,50)>帝京(47,47.5 )>横浜薬科(44, 47.5)
問1
原子量 C 12.0, N 14.0, O 16.0, S 32.0, Cl 35.5, Ca 40.0, Mn 55.0
気体定数 8.31×103 Pa・L/(mol・K)
<< ヒント >>
(3) PV = nRT より気体の物質量(mol)を求め、沈殿Eと気体との化学反応式より沈殿Eの物質量(mol)を求め、式量を求めた上で、質量(g)を求める。
答
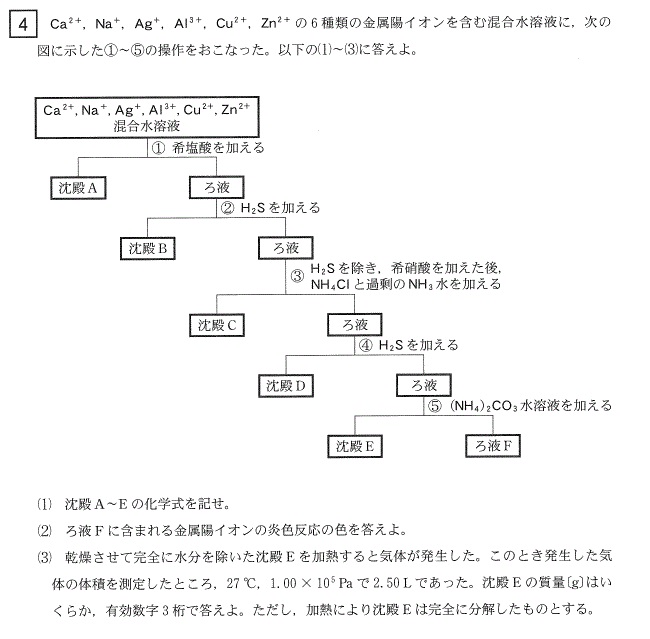
(1) A AgCl B CuS C Al(OH)3 D ZnS E CaCO3 F Na+
(2) 黄色
(3) 10.0 g
問2

答
(1) A PbCl2 B Fe(OH)3 C ZnS D BaSO4
(2) 赤色
問3

答
(1) b, e (2) a, d (3) c, f (4) a, e (5) a, b (6) e, f
<< 解法のポイント >>
(1)~(3) 硫化物(S2-)と沈殿[参(酸)議院(Ag)どう(Cu)か(Cd)な(Pb)、塩基はあえ(Zn)て(Fe)煮(Ni)こ(Co)まん(Mn)]
イオン化傾向が大きいと沈殿せず、大さいと塩基~酸のすべてで沈殿する。
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
(4) 過剰のアンモニア(NH3)に溶ける[度(Cu)を過ぎ(Ag)てあえ(Zn)なく溶けるアンモニア]
Cu → Cu(OH)2 → [Cu(NH3)4] 2+ 正方形
Ag → Ag2O → [Ag(NH3)2] + 直線形
Zn → Zn(OH)2 → [Zn(NH3)4] 2+ 正四面体
※ NH3 の電離度は小さいので、両性元素のうちのZnのみが溶ける。
(5) 過剰の水酸化ナトリウム(NaOH)に溶ける。
Al → Al(OH)3 → [Al(OH)4] +
Zn → Zn(OH)2 → [Zn(OH)4] 2+ 正四面体
Sn → Sn(OH)2 → [Sn(OH)4]
2+ 正四面体
Pb → Pb(OH)2 → [Pb(OH)4] 2+
※
全ての両性元素は過剰のNaOHaqで錯イオンをつくり溶ける。[あ(Al)あ(Zn)すん(Sn)なり(Pb)両性に愛される]
(6) 硫酸イオン( SO42-)と白色沈殿[馬(Ba)鹿(Ca)な(Pb)硫酸]
BaSO4
(胃の検査で使用するバリウムの主成分) PbSO4(鉛蓄電池に使用)
問4

答
(1) (ア) アルカリ土類 (イ) ストロンチウム (ウ) 水素 (エ) 硫酸
(2) (ⅰ) 橙赤 (ⅱ) 黄緑
<< 解法のポイント >>
(H 除く1族)アルカリ金属 [リッチ(Li)なかあ(Ca)ちゃんルビー(Rb)せし(Cs)めてフラ(Fr)ンスへ]
(Be,Mg 除く2族)アルカリ土類金属[キャッ(Ca)スル(Sr)にバ(Ba)ラ(Ra)]
炎色反応[リアカー(Li赤)無き(Na黄)K村(K紫)動力(Cu青緑)借ろうと(Ca橙)するもくれない(Sr紅)馬力(Ba黄緑)]
Li赤 Na黄 K 紫 Cu青緑 Ca橙 Sr紅 Ba黄緑

コメントをお書きください