<< 問題 >>
149 中和反応後のpH
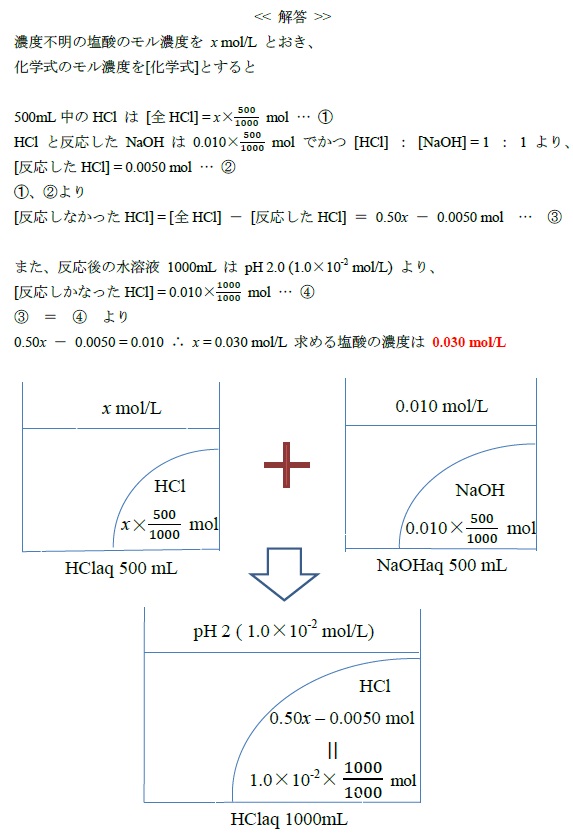
濃度不明の塩酸500 mL と 0.010 mol/L の水酸化ナトリウム水溶液 500 mL を混合したところ、溶液の pH は 2.0 であった。この塩酸の濃度[mol/L] を求めよ。
<< 解法のポイント >>
中和反応と pH の融合問題です。中和反応後、水溶液は HClaq になっていて、このとき pH 2.0 よりモル濃度が 0.010 mol/Lの塩酸1000mLに変化していることがわかるかテストしています。ここで、pH 2.0 より酸性溶液になっていることから、NaOHはすべてHClと反応してNaCl と H2O に変化しています。変化後のNaClは中性の塩でH2Oも中性ですから、pHには影響を与えません。その結果、pHに影響を与えているのは反応しなかったHCl のみとなります。
<< 要求される学力レベル >>
センター試験レベルの基本問題ですが、公立高校入試で特色検査を受け数学も80%~90%台の学生たちの多くが、この程度の基本問題を自力では解けず苦戦しています。
公立高校入試では表面的な理解でも大量の問題を解くことで高得点できてしまうので、鍛えているつもりでも実際には(難度の高い問題に対して)鍛え方が足りず、弱い思考力ゆえに高校に進んで直ぐに壁にぶつかってしまいます。地方の生徒の場合には、自覚するのが(遅すぎますが)高2の終わりから高3になってからがほとんどです。大学受験が終わるまで自覚できない生徒も多くいます。
学区のトップ高でも定期試験は易しくて競争も緩くかつ高校入試の成功体験も邪魔をして、学力が低いことを自覚できないようです。都会の生徒たちは競争が激しく受験の厳しさを自覚している生徒が多く、向上心も強く難度を上げても自力で解こうと努力するので、受験科目の指導に専念できますが、地方の生徒の多くは、受験に関して甘い環境にあり大学受験の厳しさを自覚しづらいこともあり、難度が少し高くなるだけで挑戦を避ける傾向が強く、受験科目の指導以前の難しさがあります。

コメントをお書きください