「金属イオンの性質」に関する入試問題を解説します。難易度は基本で易。
帝京大学(薬) (制限時間10分)

解説
1~2. 刺激臭はSO2, 腐乱臭はH2S。どちらも無色。箱根の大涌谷で注意事項の看板があるのは、これらが無色で有毒だから。
3. 金属イオンの検出で、酸性溶液と塩基性溶液で沈殿物に違いがあるのは、H2Sの電離度が低いことによる。
すなわち、H2S,SO2共に弱酸性。
4. K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
黒色は、沈殿しない。
青色は、塩基性~中性で沈殿する。ZnS(白)
ピンクは、全ての液性で沈殿する。PbS(黒)
沈殿物の多くは、黒色。黒以外の色になるのは、ZnS(白)、CdS(黄)、MnS(淡赤)、SnS(褐)
5. FeS + H2SO4 → FeSO4 + H2S、FeS + 2HCl → FeCl2 + H2S。少し溶ける場合、水上置換は使わない。
H2S(分子量34)は空気(29)より重いので、下方置換。
※ CO2は、高純度を要求されるなら水上置換でそうでなければ下方置換で捕集する。
6. 酸化還元反応で、Sが析出する。2H2S + SO2 → 2H2O + 3S
7. FeS + 2HCl → FeCl2 + H2S
FeSは0.88/88 = 0.01 mol、HClは1.00 × 10/1000 = 0.01 mol、反応に使う物質量の比は、1 : 2 より、FeSが0.005mol 残る。
H2S は 0.005 mol 発生するので、その質量は 34 × 0.005 = 0.170 (g)
答
1. (ア) 2. (イ) 3. (イ) 4. (ア) 5. (イ) 6. S 7. (キ)
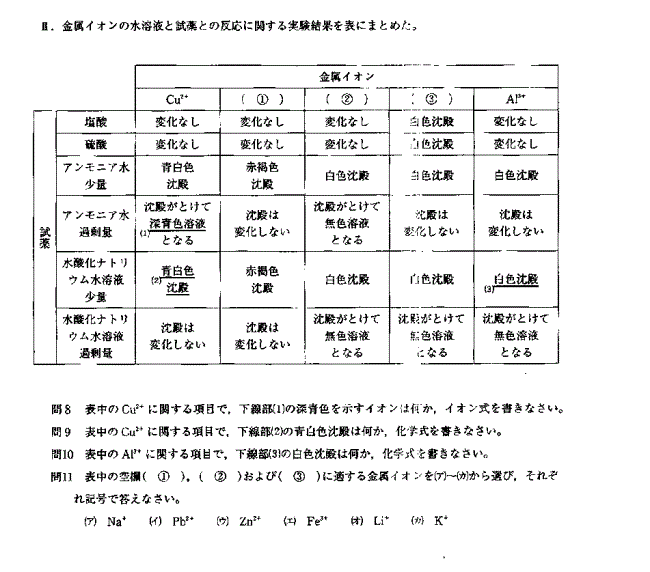
解説
両性元素 (NaOHaq)
Al → Al(OH)3 → [Al(OH)4]-
Zn → Zn(OH)2 → [Zn(OH)4]2-
Sn → Sn(OH)2 → [Zn(OH)4]2-
Pb → Pb(OH)2 → [Zn(OH)4]2-
両性元素(NH3aq)
Al → Al(OH)3
Zn → Zn(OH)2 → [Zn(NH3)4]2+
Sn → Sn(OH)2
Pb → Pb(OH)2
その他(NH3aq)
Ag+ → Ag2O → [Ag(NH3)2]+
Cu2+→ Cu(OH)2 → [Cu(NH3)4]2+
Fe3+→ Fe(OH)3 (赤褐色)
Fe2+→ Fe(OH)2 (緑白色)
アルカリ金属(Li+, Na+, K+)は沈殿しない。
答
8. [Cu(NH3)4]2+ 9. Cu(OH)2 10. Al(OH)3 11. ➀ (エ) ② (ウ) ③ (イ)

コメントをお書きください