センター試験向けの電気分解です。


[解法の前提となる基礎知識]
・陽極には陰イオンが引きつけられる。酸化され易さは SO42-, NO3-, CO32-, PO43- < OH-, H2O の O2- < Br-, Cl-
SO42-, NO3-, CO32-, PO43- は酸化されない。
このとき、OH-以外に陰イオンがなければH2OまたはOH-のO2-が02に酸化される。すなわち、酸化されるイオンに着目すると
2O2- → O2 + 4e-
Br-, Cl-が存在する場合は、
2Br- → Br2 + 2e-, 2Cl- → Cl2 + 2e-
・陰極には陽イオンが引きつけられる。
このとき、イオン化傾向の小さいイオンが還元される。
[解法のポイント]
①~④については、陽極・陰極で発生前後のイオンと単体のみの酸化還元に着目し、
比(導線中を流れる電子e-の物質量:電気分解で発生した気体の物質量)を求める。
”上の解答例”のように、イオン反応式から物質量を求めようとすると時間がかかり実戦的ではない。
[解法]
実験:導線中を流れる電子e-の物質量:電気分解で発生した気体の物質量 = 0.01 :0.01 = 1:1
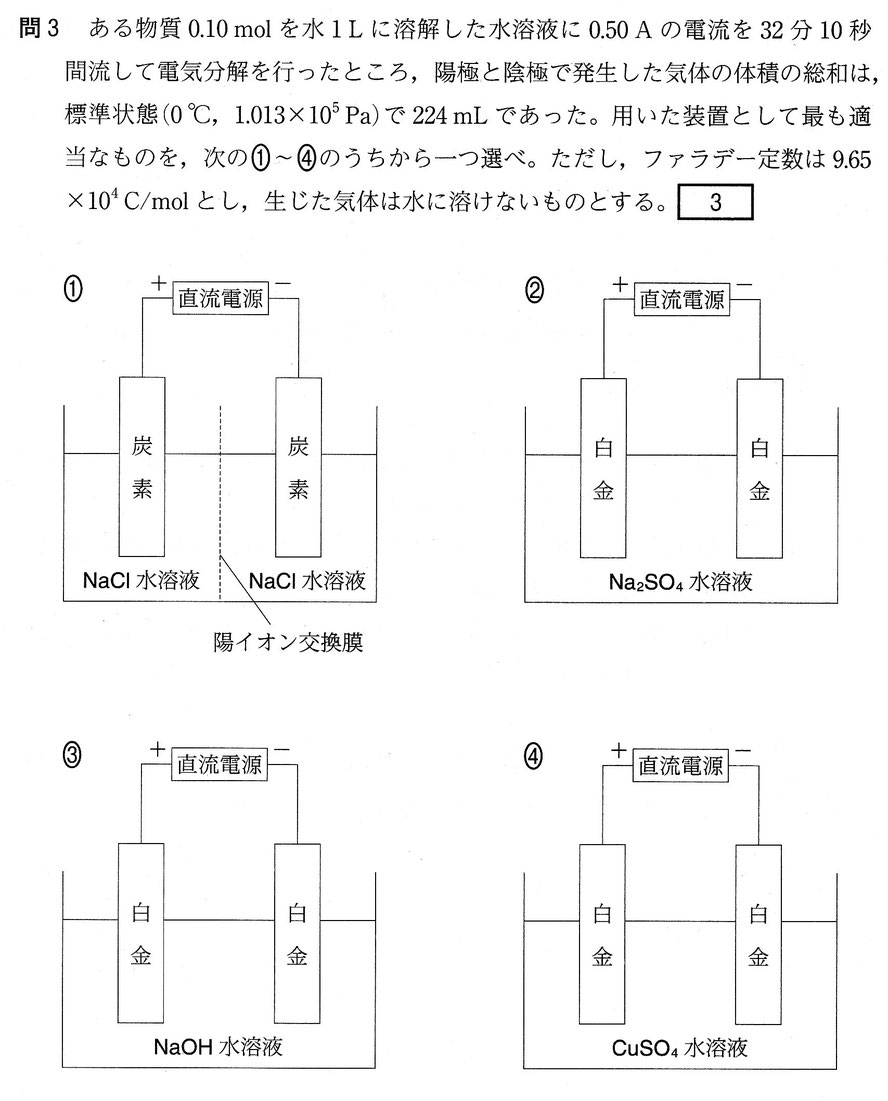
①
陽極:酸化され易さは H2OのO2-< Cl-より、2Cl- → Cl2 + 2e-
陰極:イオン化傾向はNa+ > H2OのH+ より、2H+ + 2e- → H2
導線中を流れる電子e-の物質量:電気分解で発生した気体の物質量=2:2 = 1:1
②
陽極:酸化され易さはSO42-< H2OのO2- より、2O2- → O2 + 4e-
陰極:イオン化傾向はNa+ > H2OのH+ より、4H+ + 4e- → 2H2
導線中を流れる電子e-の物質量:電気分解で発生した気体の物質量=4:3
③
陽極:酸化され易さはOH-のO2-より、2O2- → O2 + 4e-
陰極:イオン化傾向はNa+ > H2OのH+ より、4H+ + 4e- → 2H2
導線中を流れる電子e-の物質量:電気分解で発生した気体の物質量=4:3
④
陽極:酸化され易さはSO42-< H2OのO2-より、2O2- → O2 + 4e-
陰極:イオン化傾向はH2OのH+ > Cu2+より、2Cu2+ + 4e- → 2Cu
導線中を流れる電子e-の物質量:電気分解で発生した気体の物質量=4:1
注:Cuは個体であるから対象から外す。
以上より、正解は①

コメントをお書きください